Distribución pigmentaria normal y patrones reactivos cutáneos en pacientes de etnia africana. Aprender a leer la piel una vez más.
Palabras clave:
etnia africana, pigmentación cutánea, patrones reactivos cutáneosResumen
La migración de la población de origen africano a Latinoamérica en las últimas décadas plantea un desafío a los dermatólogos que tratan a pacientes caucásicos o de los pueblos originarios. Por lo tanto, la etnia africana aporta una nueva manera de encarar la dermatología. La peculiar pigmentación mucocutánea y de las faneras que presenta esta piel, se asocia a la hiperproducción de melanina y a la dispersión de los melanosomas. La ausencia de eritema, la labilidad pigmentaria, ya sea por hipopigmentación o hiperpigmentación posinflamatoria, el desarrollo de patrones de respuesta cutáneos particulares desconciertan a los dermatólogos inexpertos y los llevan a cometer errores diagnósticos y adoptar conductas terapéuticas inadecuadas. En este artículo se describen las variaciones normales de la pigmentación cutánea y los patrones de respuesta frecuentes en las dermatosis de los pacientes de raza negra.
Referencias
I. Marín D, Del Pozo A. Pigmentación de la piel (I). Melaninas: conceptos generales e implicaciones cosméticas. OFFRAM 2005;24:116-118.
II. Moreno Ribera N. Características y dermatosis propias de la piel oscura. Med Cutan Iber Lat Am 2016;44:11-23.
III. Taylor SC. Skin of color: Biology, structure, function, and implications for dermatologic disease. J Am Acad Dermatol2002;46:S41–62.
IV. Badreshia-Bansal S, Taylor SC. Chapter 12: The structure and function of skin of color, en: Kelly AP, Taylor SC. Dermatology for skin of color. McGraw-Hill, Nueva York, 2009:71-77.
V. Somani VK, Razvi F, Sita VNVL. Pigmentary demarcation lines over the face. Indian J Dermatol Venereol Leprol 2004;70:336-341.
VI. James WD, Carter JM, Rodman OG. Pigmentary demarcation lines: a population survey. J Am Acad Dermatol 1987;16:584-590.
VII. Maleville J, Alain Taïeb A. Pigmentary demarcation lines as markers of neural development. Arch Dermatol 1997;133:1459.
VIII. Bukhari IA. Effective treatment of Futcher’s lines with Q-switched alexandrite laser. J Cosmet Dermatol 2005;4:27-28.
IX. Ustuner P, Bedir R. Case of recurrent type B pigmentary demarcation lines in a pregnant woman. Asian J Dermatol2015;7:13-16.
X. Gupta LK, Srivastava A, Khare AK, Mittal A, et ál. Type B pigmentary demarcation lines.Indian Dermatol Online J2016;7:224-225.
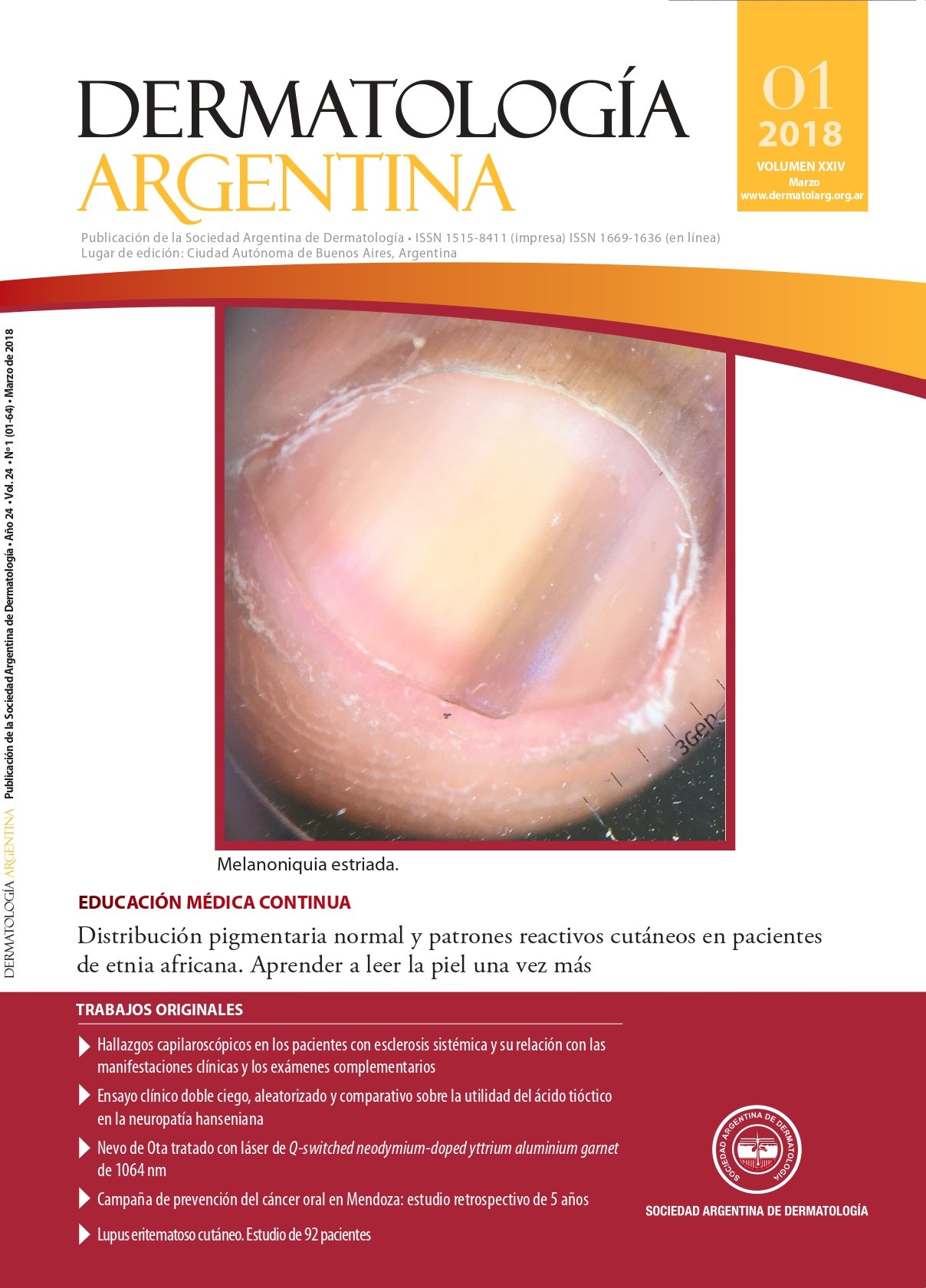
XI. Caballero Escuti G, Hernández M, Valente E, Arancibia A, et ál.Melanoma subungueal. Comunicación de tres casos y revisión de la literatura. Dermatol Argent 2013;19:183-187.
XII. Henderson AL. Skin variations in blacks. Cutis 1983;32:376-377.
XIII. Bonnecaze AK, Willeford W. Keratosis punctata of the palmar creases in a 68-years-old African-American man. BMJ Case Reports 2016; 2016.
XIV. Eisen D. Disorders of pigmentation in the oral cavity. Clin Dermatol 2000;18:579-587.
XV. Marcoval J, Notario J, Martín-Sala S, Figueras I. Pigmentación de las papilas fungiformes linguales. A propósito de dos casos. Actas Dermosifiliogr 2011;102:739-740.
XVI. Madani FM, Kuperstein AS. Normal variations of oral anatomy and common oral soft tissue lesions: evaluation and management. Med Clin North Am 2014;98:1281-1298.
XVII. Leung AK, Barankin B. Pearly penile papules. J Pediatr2014;165:409.
XVIII. Kelly AP. Chapter 13: Nuances in skin of color, en: Kelly AP, Taylor SC. Dermatology for skin of color. McGraw-Hill, Nueva York, 2009:78-84.
XIX. Gledhill K, Rhodes LE, Brownrigg M, Haylett AK, et ál. Prostaglandin-E2 is produced by adult human epidermal melanocytes in response to UVB in a melanogenesis- independent manner. Pigment Cell Melanoma Res 2010;23:394-403.
XX. Starner RJ, McClelland L, Abdel-Malek Z, Fricke A, et ál. PGE(2) is a UVR-inducible autocrine factor for human melanocytes that stimulates tyrosinase activation. Exp Dermatol 2010;19:682-684.
XXI. Morelli JG, Norris DA. Influence of inflammatory mediators and cytokines on human melanocyte function. J Invest Dermatol1993;100:191S-195S.
XXI.. Schiller M, Metze D, Böhm M. Idiopathic guttate hypomelanosis. Hautarzt 1997;48:662-665.
XXIII. Yashar S, Haley J. Chapter 14: Skin lesions: Normal and pathologic, en: Kelly AP, Taylor SC. Dermatology for skin of color. McGraw-Hill, Nueva York, 2009:85-91.
XXIV. Puigdemont GS, Viscasillas XB, López-Reynals RS, Vinardell MI. Aspectos clínicos específicos de las dermatosis en razas pigmentadas. Piel 2003;18:313-319.
XXV. Grimes PE, Arora S, Minus HR, Kenney JA Jr. Dermatosis papulosa nigra. Cutis 1983;32:385-386, 392.
XVI. Tawfik A, Osman MA, Rashwan I. A novel treatment of acne keloidalis nuchae by long-pulsed alexandrite laser. DermatolSurg 2018;413-420.
XXVII. Ogunbiyi A. Acne keloidalis nuchae: prevalence, impact, and management challenges. Clin Cosmet Investig Dermatol 2016; 9:483-489.
XVIII. Verma SB, Wollina U. Acne keloidalis nuchae; another cutaneous symptom of metabolic syndrome, truncal obesity and impending overt diabetes mellitus. Am J Clin Dermatol 2010;11:433-436.
XXIX. Gray J, McMichael AJ. Pseudofolliculitis barbae: understanding the condition and the role of facial grooming. Int J Cosmet Sci2016;38 Suppl 1:24-27.
XXX. Sehgal VN, Srivastava G. Fixed drug eruption (FDE): changing scenario of incriminating drugs. Int J Dermatol 2006;45:897-908.
XXXI. Jacyk WK. Dermatosis corrientes en pacientes africanos de raza negra (I). Actas Dermosifiliogr 1998;89:291-303.
XXXII. Huang C, Murphy GF, Akaishi S, Ogawa R. Keloids and hypertrophic scars: update and future directions. Plast Reconstr Surg Glob Open 2013;1:e25.
Publicado
Número
Sección
Licencia
Derechos de autor 2018 Sociedad Argentina de Dermatología

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
El/los autor/es tranfieren todos los derechos de autor del manuscrito arriba mencionado a Dermatología Argentina en el caso de que el trabajo sea publicado. El/los autor/es declaran que el artículo es original, que no infringe ningún derecho de propiedad intelectual u otros derechos de terceros, que no se encuentra bajo consideración de otra revista y que no ha sido previamente publicado.
Le solicitamos haga click aquí para imprimir, firmar y enviar por correo postal la transferencia de los derechos de autor