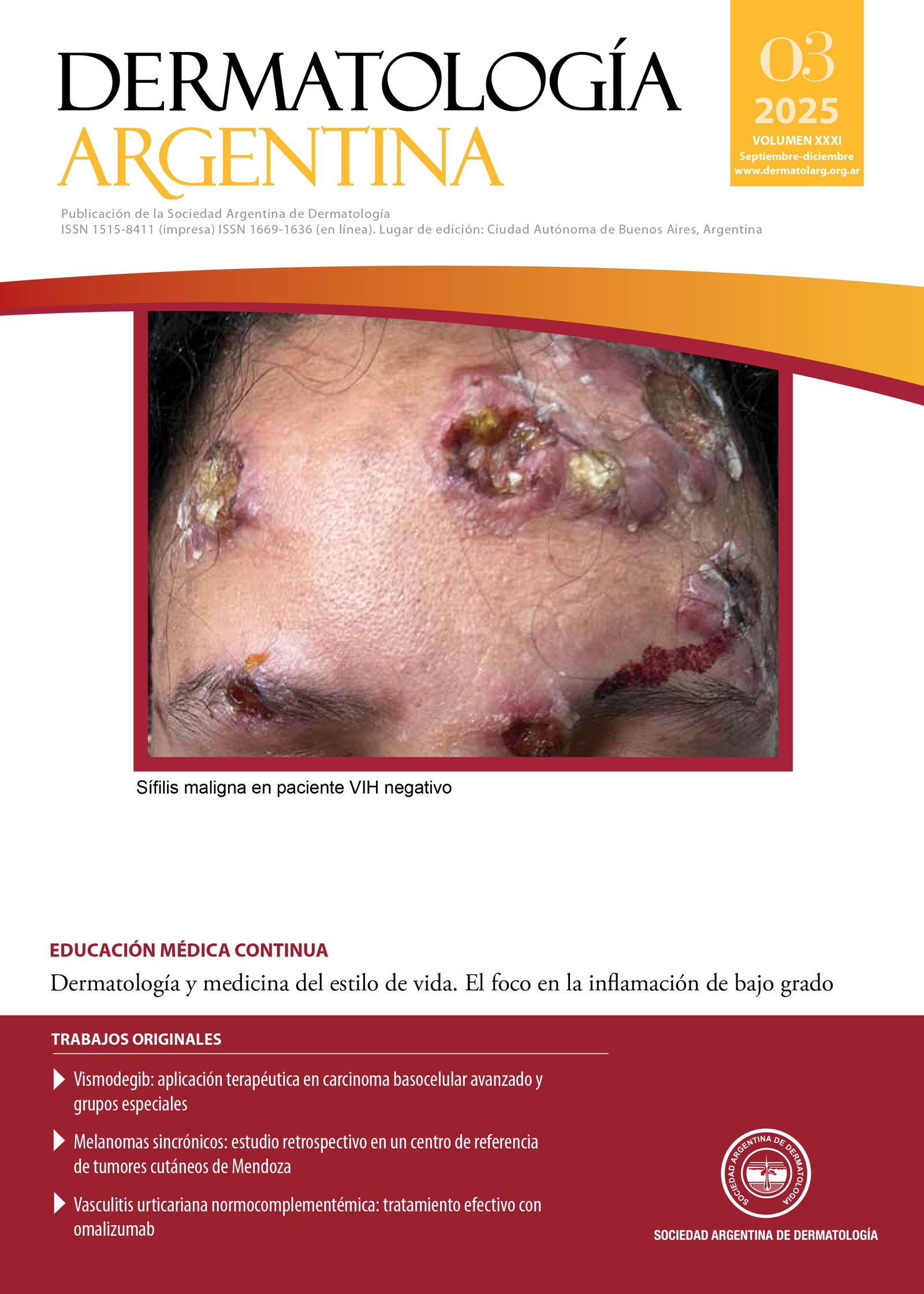
Impacto de los psicofármacos en la piel: reacciones adversas y su manejo. Revisión sistemática
DOI:
https://doi.org/10.47196/da.v31i3.2961Palabras clave:
psicotrópicos, psicofármacos, efectos adversos, reacción adversa, efecto adverso por drogas, dermatologíaResumen
Los psicofármacos han revolucionado el tratamiento de los trastornos psiquiátricos, pero su uso conlleva riesgos de reacciones cutáneas adversas (RCA) que pueden variar desde leves hasta mortales. En este trabajo hemos realizado una revisión sistemática explorando en detalle estas RCA, y distinguiendo entre aquellas relacionadas con el sistema inmunitario y las que no. También se analizaron sus características y opciones de tratamiento. Aunque los exantemas y el prurito son las RCA más comunes, los psicofármacos pueden desencadenar una variedad de dermatosis, incluyendo el síndrome de Stevens-Johnson. Es importante interpretar con cautela la reacción cutánea como consecuencia de un psicofármaco específico en el contexto del tratamiento de salud mental, ya que suspenderlo sin una confirmación de su asociación puede tener riesgos en la estabilidad del tratamiento psiquiátrico. El dermatólogo desempeña un papel esencial en el cuidado multidisciplinario de estos pacientes, contribuyendo al diagnóstico y tratamiento de las RCA.
Referencias
I. Kristensen KB, Pedersen SA, Schmidt SAJ, Pottegård A. Use of antiepileptic drugs and risk of skin cancer. A nationwide case-control study. J Am Acad Dermatol. 2020;82:326-335
II. Lange-Asschenfeldt C, Grohmann R, Lange-Asschenfeldt B, Engel RR, et ál. Cutaneous adverse reactions to psychotropic drugs: data from a multicenter surveillance program. J Clin Psychiatry. 2009;70:1258-1265.
III. Pratt LA, Brody DJ, Gu Q. Antidepressant use in persons aged 12 and over: United States, 2005-2008. NCHS Data Brief. 2011:1-8
IV. Wang F, Zhao Y-K, Li M, Zhu Z, et ál. Trends in culprit drugs and clinical entities in cutaneous adverse drug reactions: a retrospective study. Cutan Ocul Toxicol. 2017;36:370-376.
V. Deb N, Dey D, Roy P. Psychotropic medications and dermatological side effects: an in-depth review. Psychoactives. 2024:3:22-24.
VI. Edinoff AN, Nguyen LH, Fitz-Gerald MJ, Crane E, et ál. Lamotrigine and Stevens-Johnson syndrome prevention. Psychopharmacol Bull. 2021;51:96-114.
VII. Xu YY, Sun ZL, Zhang XL, Liu ZL, et ál. Carbamazepine induced Stevens-Johnson syndrome in Han Chinese with positive HLA-A * 3101 gene: a case report. Beijing Da Xue Xue Bao. 2023;55:755-757.
VIII. Bolaños-Rosales DM, Xajil-Ramos LY, González-Salazar LS. Medicamentos inductores a reacciones cutáneas severas reportados en países de Iberoamérica. Revisión. Rev Ofil Ilaphar. 2023;33:174-181.
IX. Kimyai-Asadi A, Harris JC, Nousari HC. Critical overview: adverse cutaneous reactions to psychotropic medications. J Clin Psychiatry. 1999;60:714-725.
X. Common terminology criteria for adverse events v3.0 (CTCAE). En: Principles and Practice of Clinical Trial Medicine. Elsevier 2008;461-533.
XI. Haanen JBAG, Carbonnel F, Robert C, Kerr KM, et ál. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28:119-142.
XII. Allain H, Chevrant-Breton J, Beneton C, Bousser AM, et ál. Conséquences dermatologiques indésirables des médicaments. Résultat d’une enquête de pharmacovigilance. Ann Med Interne. 1983;134:530-536.
XIII. Hernández RJM, Hierro S, Achell L. Patogenia del prurito en pacientes psiquiátricos. Revisión de la bibliografía y reporte de un caso. Dermatología CMQ. 2010;8:128-135.
XIV. Garnis-Jones S. Dermatologic side effects of psychopharmacologic agents. Dermatol Clin. 1996;14:503-508.
XV. Lozzi F, Di Raimondo C, Lanna C, Diluvio L, et ál. Latest evidence regarding the effects of photosensitive drugs on the skin. Pathogenetic mechanisms and clinical manifestations. Pharmaceutics. 2020;12:1104.
XVI. Mercke Y, Sheng H, Khan T, Lippmann S. Hair loss in psychopharmacology. Ann Clin Psychiatry. 2000;12:35-42.
XVII. Kass J, Hsu S. What is your diagnosis? Hyperpigmentation due to long-term chlorpromazine use. Cutis. 2001;68:252-260.
XVIII. Mishra B, Praharaj SK, Prakash R, Sinha VK. Aripiprazole-induced acneiform eruption. Gen Hosp Psychiatry. 2008;30:479-481.
XIX. Aksoy I, Orum M. Haloperidol decanoate-induced acneiform eruption: a case report. Med Sci. 2018:707.
XX. Mufaddel A, Osman OT, Almugaddam F. Adverse cutaneous effects of psychotropic medications. Expert Rev Dermatol. 2013;8:681-692.
XXI. Zaccara G, Franciotta D, Perucca E. Idiosyncratic adverse reactions to antiepileptic drugs. Epilepsia. 2007;48:1223-1244.
XXII. Bloom R, Amber KT. Identifying the incidence of rash, Stevens-Johnson syndrome and toxic epidermal necrolysis in patients taking lamotrigine: a systematic review of 122 randomized controlled trials. An Bras Dermatol. 2017;92:139-141.
XXIII. Alvarado M, Villamonte DS, Araúz C. Reporte de un caso clínico y revisión: síndrome de Stevens Johnson por uso de Lamotrigina. Pediátr Panama. 2018;3:29-36.
XXIV. Deshmukh RP. Olanzapine-induced reversible skin eruption. Indian J Psychiatry. 2023;65:607-609.
XXV. Naisbitt DJ, Farrell J, Wong G, Depta JPH, et ál. Characterization of drug-specific T cells in lamotrigine hypersensitivity. J Allergy Clin Immunol. 2003;111:1393-1403.
XXVI. Mullins E, Guajardo N, Fuenzalida M, Clavero F. Reacciones cutáneas adversas a anticonvulsivantes y estabilizadores del ánimo. Rev Chil Dermatol. 2011;27:71-76.
XXVII. Schneck J, Fagot J-P, Sekula P, Sassolas B, et ál. Effects of treatments on the mortality of Stevens-Johnson syndrome and toxic epidermal necrolysis. A retrospective study on patients included in the prospective EuroSCAR Study. J Am Acad Dermatol. 2008;58:33-40.
XXVIII. Husain Z, Reddy BY, Schwartz RA. DRESS syndrome: Part I. Clinical perspectives. J Am Acad Dermatol. 2013;68:693.e1-14; quiz 706-8.
XXIX. Lange-Asschenfeldt C, Grohmann R, Lange-Asschenfeldt B, Engel RR, et ál. Cutaneous adverse reactions to psychotropic drugs: data from a multicenter surveillance program. J Clin Psychiatry. 2009;70:1258-1265.
XXX. Schmid S, Kuechler PC, Britschgi M, Steiner UC, et ál. Acute generalized exanthematous pustulosis: role of cytotoxic T cells in pustule formation. Am J Pathol. 2002;161:2079-2086.
XXXI. Jakhar J, Badyal R, Kumar S, Prasad S. Olanzapine-induced acute generalized exanthematous pustulosis: a case report. Indian J Psychiatry. 2021;63:411-413.
XXXII. Sassolas B, Haddad C, Mockenhaupt M, Dunant A, et ál. ALDEN, an algorithm for assessment of drug causality in Stevens-Johnson syndrome and toxic epidermal necrolysis: comparison with case-control analysis. Clin Pharmacol Ther. 2010;88:60-68.
XXXIII. Gupta MA, Gupta AK, Haberman HF. The self-inflicted dermatoses: a critical review. Gen Hosp Psychiatry. 1987;9:45-52.
XXXIV. Joly P, Janela B, Tetart F, Rogez S, et ál. Poor benefit/risk balance of intravenous immunoglobulins in DRESS. Arch Dermatol. 2012;148:543-544.
XXXV. Moreno M, Wielandt AM, Encina G, Ortiz L. Farmacogenética en psiquiatría: estudio de variantes alélicas del CYP450 en pacientes chilenos con patología psiquiátrica. Rev médica Clin Las Condes. 2022;33:58-67.
Descargas
Publicado
Número
Sección
Licencia
Derechos de autor 2025 a nombre de los autores. Derechos de reproducción: Sociedad Argentina de Dermatología

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
El/los autor/es tranfieren todos los derechos de autor del manuscrito arriba mencionado a Dermatología Argentina en el caso de que el trabajo sea publicado. El/los autor/es declaran que el artículo es original, que no infringe ningún derecho de propiedad intelectual u otros derechos de terceros, que no se encuentra bajo consideración de otra revista y que no ha sido previamente publicado.
Le solicitamos haga click aquí para imprimir, firmar y enviar por correo postal la transferencia de los derechos de autor